Pendahuluan
Latar belakang
Elektron mempunyai muatan listrik negatif yang mengelilingi inti atom. Hal ini tidak jauh berbeda bila anda mengamati benda-benda langit, seperti planet-planet yang mengelilingi matahari. Elektron bergerak pada lintasannya dan terikat dengan inti atom itu sendiri. Akan tetapi elektron yang bergerak pada garis paling luar mudah lepas, dan bila lepas berarti keluar dari inti atom itu sendiri
Jika elektron-elektron tersebut lepas dari lintasannya atau orbitnya maka elektron tersebut dinamakan elektron bebas. Elektron yang keluar atau terlepas dari orbitnya tersebut biasanya karena pengaruh dari luar. Elektron yang terlepas inilah yang menghasilkan energi yang disebut dengan energi atau arus listrik. Akibat gesekan ini timbul panas atau percikan bungan api seperti sepotong besi dipukul dengan palu. Percikan bunga api itulah yang disebut elektron bebas. Pada logam banyak terdapat elektron bebas, sementara pada plastik dan kayu hampir atau bahkan sama sekali tidak ada elektronnya karena elektron benda tersebut hampir terikat dengan atomnya
Baterai atai aki pada ujung-ujungnya yang negatif (-) dan positif (+) apabila dipertemukan dengan seutas kawat logam, maka elektronnya bisa meloncat keluar atau terlepas dari inti atomnya. Dimana arus elektron dengan arus listrik bergerak secara berlawanan
tujuan
1.mempelajari lintasan electron
Kajian pustaka
Pada tahun 1913 Niels Bohr mencoba menjelaskan model atom Bohr melalui konsep elektron yang mengikuti orbit mengelilingi inti atom yang mengandung proton dan neutron. Menurut Bohr, hanya terdapat orbit dalam jumlah tertentu, dan perbedaan antar orbit satu dengan yang lain adalah jarak orbit dari inti atom. Keberadaan elektron baik di orbit yang rendah maupun yang tinggi sepenuhnya tergantung oleh tingkatan energi elektron. Sehingga elektron di orbit yang rendah akan memiliki energi yang lebih kecil daripada elektron di orbit yang lebih tinggi.
Bohr menghubungkan elektron yang mengorbit dan pengamatan terhadap spektrum gas melalui sebuah pemikiran bahwa sejumlah energi yang dikandung dalam elektron dapat berubah, dan karena itu elektron dapat mengubah orbitnya tergantung dari perubahan energinya. Dalam situasi pemakaian arus listrik melewati gas bertekanan rendah, elektron menjadi de-eksitasi dan berpindah ke orbit yang lebih rendah. Dalam perubahan ini, elektron kehilangan sejumlah energi yang merupakan perbedaan tingkat energi kedua orbit. Energi yang dipancarkan ini dapat dilihat dalam bentuk sebuah photon cahaya yang panjang gelombangnya berdasar pada perbedaan tingkat energi kedua orbit.
Secara ringkas, Bohr mengemukakan:
1. Elektron dalam atom bergerak mengelilingi inti pada lintasan-lintasan tertentu, tidak memancarkan energi. Lintasan-lintasan elektron itu disebut kulit atau tingkat energi elektron.
2. Elektron dapat berpindah dari satu lintasan ke lintasan yang lain.
3. Perpindahan elektron dari tingkat energi tinggi ke rendah disertai pemancaran energi. Sedang perpindahan elektron dari tingkat energi rendah ke tinggi disertai penyerapan energi.
4. Elektron yang bergerak pada lintasannya berada pada keadaan stasioner, artinya elektron tidak memancarkan atau menyerap energi.
Walaupun model atom Bohr cukup untuk memodelkan spektrum hidrogen, model ini terbukti tidak cukup untuk memprediksikan spektrum elemen yang lebih kompleks
Model atom yang dikemukakan oleh Joseph John Thompson mempunyai banyak kelemahan, demikian pula dengan model atom yang dikemukakan oleh Ernest Rutherford. Model atom Rutherford tidak dapat menjelaskan alasan mengapa elektron tidak dapat jatuh kedalam inti. Fisika klasik menyatakan bahwa apabila terdapat suatu partikel bermuatan yang bergerak menurut lintsan lengkung maka energinya akan hilang dalam bentuk radiasi. Pernyataan fisika klasik ini menjadi persoalan bagi model atom yang dikemukakan oleh Rutherford karena jika elektron bergerak mengelilingi inti, maka elektron akan kehilangan energinya dan energi kinetik elektron akan terus berkurang. Gaya tarik inti atom terhadap elektron akan menjadi lebih besar daripada gaya sentrifugal lintasan elektron dan menyebabkan lintasan menjadi spiral dan akhirnya elektron jatuh kedalam inti atom. Apabila elektron jatuh kedalam inti atom, maka atom menjadi tak stabil. Hal ini bententangan dengan pernyataan umum bahwa atom stabil.
 Lintasan spiral elektron
Lintasan spiral elektron
Spektrum garis
Menurut Max Planck radiasi elektromagnetik bersifat diskontinyu atau dalam bentuk kuanta. Diskontinyuitas radiasi elektromagnetik dikuatkan oleh efek fotolistrik yang dikembangkan oleh Albert Einstein. Sedangkan kuantisasi/kuanta energi digunakan oleh Niels Bohr dalam momentum sudut elektron untuk pengembangan teorinya tentang atom hidrogen.
Apabila berkas cahaya polikromatis seperti lampu listrik dan sinar matahari dilewatkan melalui prisma maka akan diperoleh spektrum kontinyu yang terdiri dari berbagai warna penyusunnya. Spektrum garis dihasilkan apabila sumber cahaya polikromatik seperti lampu listrik dan sinar matahari diganti oleh busur listrik berisi gas hidrogen maka akan dihasilkan spektrum yang tidak kontinyu. Spektrum yang tidak kontinyu berupa sederetan garis berwarna yang disebut spektrum garis tak kontinyu.
Spektrum garis didapat dengan cara sebagai berikut:
· Zat yang diselidiki spektrumnya diuapkan pada temperatur tinggi
· Uap yang terbentuk diletakkan diantara dua elektroda grafit
· Listrik bertegangan tinggi dialirkan melalui elektroda grafit
Spektrum garis yang paling sederhana adalah spektrum garis atom hidrogen. Balmer melakukan penelitian sehingga didapatkan deret Balmer untuk atom hidrogen.

Spektrum cahaya polikromatik
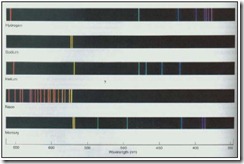
Spektrum garis

Deret Balmer untuk atom hidrogen
Teori Bohr
Seperti telah diketahui bahwa menurut Max Planck radiasi elektromagnetik bersifat diskontinyu atau dalam bentuk kuanta. Max Planck menurunkan persamaan untuk pernyataan tersebut sebagai berikut:

Pernyataan tersebut bertentangan dengan pandangan fisika klasik yang mengemukakan bahwa energi bersifat kontinyu.
Untuk mengatasi perbedaan tersebut, Niels Bohr melakukan penelitian dan mencoba menjelaskan dengan pendekatan pemecahan spektrum garis hidrogen. Bohr menggunakan pendekatan Max Planck untuk menjelaskan spektrum garis hidrogen.
Beberapa hasil penelitian Bohr diantara adalah
· Elektron mengorbit pada lintasan tertentu dan dengan tingkat energi tertentu
· Lintasan orbit elektron berbentuk lingkaran dan disebut kulit
· Momentum sudut elektron yang mengorbit berharga kelipatan  . Setiap elektron yang mengorbit mempunyai momentum sudut sebesar
. Setiap elektron yang mengorbit mempunyai momentum sudut sebesar  yang merupakan bilangan bulat positif dan disebut sebagai bilangan kuantum utama.
yang merupakan bilangan bulat positif dan disebut sebagai bilangan kuantum utama.
Bilangan kuantum utama menyatakan kulit

Hubungan Lintasan, Kulit dan Bilangan KuantumEnergi elektron berbanding terbalik dengan lintasan (kulit)
· Keadaan paling stabil adalah pada saat n = 1 yakni ketika elektron memiliki energi paling minimal
· Elektron berada dalam keadaan stasioner, tidak memancarkan dan menyerap energi, ketika elektron megorbit mengelilingi inti atom.
Apabila elektron berpindah dari tingkat energi rendah menuju tingkat energi tinggi maka energi akan diserap untuk melakukan proses tersebut. Elektron yang berpindah dari tingkat energi rendah menuju tingkat energi yang lebih tinggi menyebabkan elektron tereksitasi. Akan tetapi keadaan elektron tereksitasi ini tidak stabil sehingga elektron kembali dari tingkta energi tinggi menuju tingkat energi rendah yang disertai pelepasan energi dalam bentuk radiasi.

Model atom Bohr
Teori Bohr berhasil menjelaskan spektrum garis atom hidrogen dan ion-ion berelektron tunggal seperti 2He+ dan 3Li2+. Akan tetapi teori Bohr juga masih menunjukkan kelemahan yaitu tidak mampu menjelaskan spektrum garis atom berelektron banyak dan sifat spektrum garis dalam medan magnet serta tidak dapa menjelaskan garis-garis halus spektrum garis atom hidrogen.
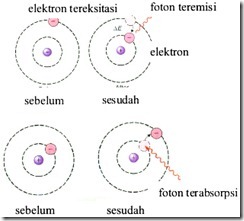
Proses eksitasi dan emisi
Contoh soal:
Berapakah energi sinar laser dengan panjang gelombang 780nm.

Konfigurasi elektron
Susunan elektron dalam atom dapat dijelaskan menggunakan konfigurasi elektron. Penyusunan elektron dalam atom didasarkan pada teori-teori berikut:
· Teori dualisme gelombang partikel yang dikemukakan oleh de Broglie pada tahun 1924. Teori ini menyatakan bahwa elektron dalam atom bersifat gelombang dan partikel.
· Azas ketidakpastian yang dikemukakan oleh Heisenberg pada tahun 1927. Teori ini menyatakan bahwa posisi dan momentum partikel tidak dapat ditentukan secara pasti dalam waktu bersamaan. Teori ini menyiratkan bahwa lintasan elektron tidak berbentuk lingkaran.
· Teori persamaan gelombang yang dikemukakan oleh ErwinSchrodinger. Teori ini dapat menerangkan pergerakan partikel-pertikel mikroskopik termasuk elektron.
Azas ketidakpastian Heisenberg menyebabkan posisi elektron tidak dapat ditentukan dengan pasti demikian pula dengan orbit elektron dalam atom menurut mekanika kuantum. Walaupun orbit elektron tidak dapat ditentukan dengan pasti tetapi peluang untuk menemukan elektron pada posisi tertentu di sekitar inti masih mungkin untuk ditentukan. Obital merupakan daerah disekiar inti dengan peluang terbesar untuk menemukan elektron. Kapasitas maksimal orbital untuk ditempati elektron sebesar 2 elektron. Orbital juga mempunyai energi yang khas bagi tiap-tiap elektron untuk menempatinya. Energi khas untuk tiap elektron ini sering disebut tingkat energi. Hanya elektron dengan energi yang cocok dapat menempati orbital tersebut. Sistem susunan elektron dalam atom dapat dilihat pada gambar berikut.
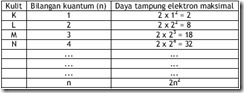
Susunan Bilangan Kuantum
Jumlah maksimum elektron dalam kulit tertentu sebesar 2n2 dengan n adalah nomor kulit. Pengisian elektron dimulai pada kulit dengan tingkat energi terendah yaitu kulit pertama atau kulit K yang dilanjutkan dengan kulit L, M, N dan seterusnya. Pengisian dilakukan dengan pengisian maksimum terlebih dahulu untuk tiap kulit. Apabila terdapat 18 elektron maka elektron akan mengisi kulit K sebanyak 2 yang dilanjutkan dengan pengisian kulit L sebanyak 8 elektron dan diakhiri dengan pengisian kulit L sebanyak 8 elektron.
Elektron valensi merupakan jumlah elektron yang terdapat pada kulit terluar suatu atom unsur. Ikatan kimia dapat terbentuk dengan memanfaatkan atau menggunakan elektron valensi sehingga elektron valensi dapat dikatakan merupakan penentu sifat kimia atom unsur.

Elektron valensi beberapa unsur periode 2 dan periode 3
| Teori Atom Dalton | | Seorang filsafat Yunani, Leucippus, berpendapat bahwa materi tersusun atas butiran-butiran kecil. Pendapat ini dikembangkan oleh muridnya, Democritus, yang menyatakan bahwa materi tersusun atas partikel-partikel yang tak dapat dibagi lagi, yaitu atom. John Dalton membuktikan pemikiran filsafat Yunani tersebut dengan menyatakan bahwa pemikiran Democritus tidak bertentangan dengan Hukum Kekekalan Massa dan Hukum Perbandingan Tetap. John Dalton Kemudian pada tahun 1803 John Dalton mengemukakan teori atomnya: - Materi tersusun dari partikel-partikel terkecil yang disebut atom.
- Unsur adalah materi yang tersusun dari atom-atom yang sejenis dengan massa dan sifatnya sama.
- Unsur yang berbeda memiliki atom-atom dengan massa dan sifat yang berbeda.
- Senyawa adalah materi yang tersusun minimal 2 jenis atom dari unsur-unsur berbeda, dengan perbandingan tetap dan tertentu. Dalam senyawa, atom-atom berikatan melalui ikatan antar atom.
- Atom tidak dapat dimusnahkan. Reaksi kimia hanyalah penataan ulang atom-atom yang bereaksi.
 Seiring perkembangan teknologi, teori atom Dalton terbukti tidaklah sepenuhnya benar. Penelitian selanjutnya mengarah bahwa ternyata atom dapat dibagi menjadi bagian-bagian kecil lain yang merupakan partikel dasar atom itu sendiri yaitu proton, elektron baru disusul neutron. Artinya atom bukanlah bagian terkecil dari suatu materi. Seiring perkembangan teknologi, teori atom Dalton terbukti tidaklah sepenuhnya benar. Penelitian selanjutnya mengarah bahwa ternyata atom dapat dibagi menjadi bagian-bagian kecil lain yang merupakan partikel dasar atom itu sendiri yaitu proton, elektron baru disusul neutron. Artinya atom bukanlah bagian terkecil dari suatu materi.
Model Atom Dalton | | | | | Teori Atom J.J. Thomson | | |  Setelah penemuan proton oleh Goldstein di tahun 1886 dan elektron oleh J.J. Thomson di tahun 1897. Kemudian pada tahun 1898 J.J Thomson mengemukakan model atomnya. Model atom Thomson menyatakan bahwa atom berbentuk bulat dimana muatan listrik positif yang tersebar merata dalam atom dinetralkan oleh elektron-elektron yang bermuatan negatif yang berada di antara muatan positif. Setelah penemuan proton oleh Goldstein di tahun 1886 dan elektron oleh J.J. Thomson di tahun 1897. Kemudian pada tahun 1898 J.J Thomson mengemukakan model atomnya. Model atom Thomson menyatakan bahwa atom berbentuk bulat dimana muatan listrik positif yang tersebar merata dalam atom dinetralkan oleh elektron-elektron yang bermuatan negatif yang berada di antara muatan positif.
J.J Thomson 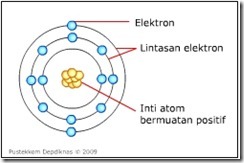 Model atom Thomson didasarkan pada asumsi bahwa massa elektron lebih kecil dari massa atom, dan elektron merupakan partikel penyusun atom. Karena atom bermuatan netral, maka elektron yang bermuatan negatif akan menetralkan suatu muatan positif dalam atom. Hal ini mendukung keberadaan proton dalam atom. Model atom Thomson didasarkan pada asumsi bahwa massa elektron lebih kecil dari massa atom, dan elektron merupakan partikel penyusun atom. Karena atom bermuatan netral, maka elektron yang bermuatan negatif akan menetralkan suatu muatan positif dalam atom. Hal ini mendukung keberadaan proton dalam atom.
Model Atom J.J Thomson Model atom Thomson diuji oleh penelitian yang dilakukan oleh Philipp Lenard pada tahun 1903, yang mempelajari tentang pengaruh fotolistrik. Ia mengamati perilaku elektron yang menembus lempeng alumunium yang sangat tipis dengan cara memodifikasi tabung sinar katode dan menempatkan lempeng tersebut di dalamnya. Jika model atom Thomson benar, maka akan ada banyak berkas elektron yang dibelokkan setelah menembus lempeng alumunium, hal ini disebabkan elektron telah kehilangan energi yang banyak karena menabrak elektron yang tersebar merata dalam muatan positif atom. Akan tetapi, ia mengamati bahwa sebagian besar elektron tidak dibelokkan. Hal ini membuktikan bahwa model atom Thomson yang menyatakan bahwa elektron tersebar merata dalam muatan positif atom, adalah tidak benar. | | | | | | Teori Atom Rutherford | | | Pada tahun 1911 Ernest Rutherford bermaksud melanjutkan penelitian Philipp Lenard, hanya saja Rutherford mengganti partikel elektron dengan partikel  dan lempeng alumunium dengan lempeng emas. dan lempeng alumunium dengan lempeng emas. Setelah penembakan partikel ![clip_image017[1] clip_image017[1]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEidSp95Khk255dTJ_T6zuTvEq9y11VRAc48u5BMuOwh-YCNKCG-C-DPHAJI5Jr4SwcZJv6oiaOTGSUMI50lqpm8JkFHSg8w051u7W7TDNkEJE6o0572WGdpxtLrZDRiSP4dF76DuygrHkM/?imgmax=800) terhadap lempeng emas, Rutherford menyimpulkan: terhadap lempeng emas, Rutherford menyimpulkan: - Sebagian besar ruang dalam atom adalah ruang hampa/kosong. Hal ini didasarkan adanya berkas partikel
![clip_image017[2] clip_image017[2]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEgSnKYiU9WWuwO_nxn87VRa-fl2CvsMiW769Qq7Ez_6PzSX5ACJRrF0iQOM0hnV5DkBF3N68_CY1_F0h72Ibl7g_AWl7B7jw7ySCvvPmYNuh7FRec3BNNwKR7J0xpVKbFbXQmQMziPqOII/?imgmax=800) yang tidak dibelokkan atau tetap diteruskan. yang tidak dibelokkan atau tetap diteruskan. - Adanya suatu bagian yang sangat kecil dan padat dalam atom yang disebut inti atom. Hal ini dibuktikan oleh partikel
![clip_image017[3] clip_image017[3]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEi08LD1_5LXmVKLAgeDCtX80HfzrPrj7ioQUKSM4zRNzbrHhqB26BX1P12DK2eU5aW9LKuLCJd_nZyMKtgjbPD0LpwwvEds-18Lidekivoy2k_EXTKwOIJYlcDJv6-4JBByo5dwVtRE8Ac/?imgmax=800) yang dipantulkan kembali oleh atom dengan jumlah yang kecil. yang dipantulkan kembali oleh atom dengan jumlah yang kecil. - Adanya muatan inti yang sejenis dengan muatan partikel
![clip_image017[4] clip_image017[4]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEi7qkqv__O2OPIkcXa0nk4pMwSADkHmZoXCgwmNMpDnpHv7-NluuhZX4oapMSypLrdoWJgIUolATikUOj3mIqsJ2TuoG9WLWEnGYCJMZsrYe9BEGgJsYyhsdot7kCFd0Ed_YApsX-AgIP0/?imgmax=800) yaitu muatan positif (proton). Hal ini didasarkan adanya berkas partikel yaitu muatan positif (proton). Hal ini didasarkan adanya berkas partikel ![clip_image017[5] clip_image017[5]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEiG6NFtGnDFBHStYvx8ZGW2vvAWp_SheFbAO-_eZT1l3ikG2SO-H50ecnvYXIe5cYQa9eATvYc_vo6P5vaH6-bgVbmuzMQbVutFdGW077pF8Yfl0y4CUaVl2gYNmDZ1cV1nWOB5ErEYR68/?imgmax=800) yang dibelokkan akibat terjadi gaya tolak-menolak dengan muatan listrik yang sejenis. yang dibelokkan akibat terjadi gaya tolak-menolak dengan muatan listrik yang sejenis. Hasil penelitian Rutherford sekaligus menggantikan model atom Thomson, Rutherford mengajukakan model atom yang menyatakan bahwa atom tersusun dari inti yang bermuatan positif dikelilingi oleh elektron-elektron yang bermuatan negatif, seperti planet mengelilingi matahari. Massa atom terpusat pada inti dan sebagian besar volum atom merupakan ruang hampa/kosong. Karena atom bersifat netral, maka jumlah muatan positif dalam inti (proton) harus sama dengan jumlah elektron. Tidak beberapa lama Rutherford mengajukan model atomnya, ternyata terdapat beberapa kelemahan. Model atom Rutherford bersifat tidak stabil karena bertentangan dengan hukum fisika klasik Maxwell. Berdasarkan hukum tersebut, jika ada partikel bermuatan (elektron) mengelilingi inti atom yang memiliki muatan yang berlawanan (proton) maka elektron akan memiliki percepatan dan memancarkan energi berupa gelombang elektromagnetik, dengan demikian lama kelamaan elektron akan kehilangan energinya. Akibatnya, jari-jari lintasan semakin kecil, hingga suatu saat elektron akan bergabung inti atom. Padahal kenyataannya, atom bersifat stabil sehingga elektron tidak bergabung dengan inti atom. Selang waktu 2 tahun dari penelitian Rutherford, pada tahun 1913, Niels Bohr berhasil memperbaiki kelemahan model atom Rutherford, melalui percobaannya terhadap spektrum atom hidrogen. Bohr berpendapat jika elektron bergerak mengelilingi inti atom berbentuk spiral (seperti yang disampaikan Rutherford) adalah benar, maka energi yang dipancarkan elektron akan menghasilkan spektrum yang bersifat kontinu. Akan tetapi, hasil pengamatan Bohr terhadap spektrum atom menggunakan spektrometer bahwa spektrum bersifat diskrit (terputus-putus). Hal ini menandakan bahwa elektron hanya memancarkan energi dengan panjang gelombang tertentu atau dengan besaran energi tertentu. | | | | | | Teori Atom Bohr | | | Sehingga menurut Bohr, adanya spektrum yang bersifat diskrit menandakan bahwa elektron berada pada lintasan-lintasan tertentu berdasarkan tingkat energinya. Hal ini dibuktikan dengan menggunakan teori kuantum Planck, hingga akhirnya Bohr mengemukakan postulatnya menjelaskan kestabilan atom dan spektrum atom hidrogen. - Setiap elektron dalam atom mengelilingi inti dalam lintasan tertentu yang stationer disebut orbit/kulit.
- Elektron dapat berpindah dari kulit yang satu ke kulit yang lain dengan memancarkan atau menyerap energi.
Model atom Bohr dapat menjelaskan kestabilan atom dan spektrum atom hidrogen. Akan tetapi model ini mempunyai beberapa kelemahan, antara lain: - Hanya dapat menjelaskan spektrum atom hidrogen dengan akurat, belum dapat menjelaskan spektrum atom yang lebih kompleks.
- Asumsi elektron mengelilingi inti atom dalam lintasan lingkaran belum tentu benar, dapat saja berbentuk elips.
- Belum dapat menjelaskan adaya garis halus pada spektrum atom hidrogen.
KONFIGURASI ELEKTRON
Model atom Bohr memperkenalkan adanya kulit atom sebagai lintasan elektron mengelilingi inti atom dengan tingkat energi tertentu.Perhatikan gambar 1 disamping, inti atom dikelilingi oleh elektron yang tersebar di tiga kulit dengan jumlah elektron disetiap kulit berbeda-beda. Bohr menyatakan bahwa lapisan kulit tersusun berdasarkan urutan tingkat energinya, artinya kulit K memiliki tingkat energi paling rendah jika dibandingkan kulit L dan dan kulit M. Susunan elektron dalam kulit-kulit elektron disebut sebagai konfigurasi elektron. Kulit atom selanjutnya disimbolkan dengan n, berturut-turut n = 1, n = 2, n = 3 dinamakan kulit K, L, M, dst., dengan jumlah elektron maksimal disetiap kulitnya mengikuti persamaan 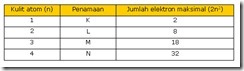 
Konfigurasi elektron menurut Bohr 
ELEKTRON VALENSI
Elektron valensi adalah jumlah elektron pada kulit atom terluar. Unsur-unsur yang memiliki jumlah elektron valensi memiliki kemiripan sifat kimia. Kesamaan elektron valensi beberapa unsur 
Unsur-unsur Li, Na dan K memiliki kemiripan sifat kimia, begitu juga F, Cl dan Br. | | | | | |
| Pendahuluan |
| ![clip_image014[1] clip_image014[1]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEgLijI55lfs-KXFhDGmg8VTkdc9vp_09dCqYpSSk7W2iQi2h7oMILExGI02t0KYBYUbLwaslu7AH2DC0EBaf6kMXCR-0uXaczQNRiox8q_5vRwCjq3DUlfiZt5ACBqItyRQDhS7nEtiC50/?imgmax=800)   
Model atom Model atom J.J Thomson Model atom Rutherford Model atom Niels Bohr Tahukah Anda kalau pengamatan suatu atom tidak dapat dilakukan dengan mata telanjang melainkan berdasarkan pengamatan jejak, warna nyala dan difraksi atom yang sudah tentu membutuhkan teknologi. Perkembangan teknologi telah mengubah segalanya, bermula dari sekedar teori sampai pembuktian bentuk atom yang nyata hingga pembuktian bentuk atom berdasarkan spektrum atom hidrogen. Teori atom bermula dari pemikiran filsuf yunani yakni Democritus dan kemudian dibuktikan oleh John Dalton berdasarkan hukum kekekalan massa dan hukum perbandingan tetap. Teori atom Dalton ini mendorong penelitian tentang adanya partikel dasar penyusun atom yaitu proton, elektron dan neutron. Berdasarkan penemuan tersebut, Rutherford mengemukakan model atom berdasarkan percobaan penembakan sinar terhadap lempeng emas. Kelemahan model atom Rutherford pun disempurnakan oleh Niels Bohr melalui penelitiannya pada spektrum atom hidrogen, hingga Niels Bohr mengemukakan postulatnya tentang model atom . |
| |
| Partikel Dasar Atom |
| ELEKTRON
Teori atom Dalton menyatakan bahwa atom merupakan bagian terkecil dari materi. Pada kenyataannya, atom dapat dibagi menjadi partikel penyusunnya yaitu elektron, neutron dan proton. Hal ini dibuktikan berdasarkan penelitian tentang arus listrik pada gas bertekanan rendah. Penelitian dimulai pada tahun 1855 oleh Heinrich Geissler, yang berhasil merancang tabung gelas bertekanan rendah yang disebut tabung Geissler. Pada tahun 1859, Julius Plucker menggunakan tabung Geissler alam percobaan elektrolisis gas, didalam tabung ia memasang 2 plat elektrode, elektrode pada kutub positif disebut anode, sedangkan elektrode pada kutub positif disebut katode. Setelah diberi tegangan tinggi, ia mengamati adanya berkas sinar yang dipancarkan dari katode. Namun Plucker menganggap sinar tersebut sebagai cahaya listrik biasa. Pada tahun 1876, Eugene Goldstein, menggunakan teknik yang sama dengan Plucker, namun ia menamakan berkas sinar yang dipancarkan dari katode sebagai sinar katode. Pertanyaan yang muncul adalah apakah sinar katode itu sebagai gelombang elektromagnetik atau partikel? Wiliam Crookes, pada tahun 1880, memodifikasi tabung Geissler untuk membuat vakum lebih baik, tabung ini disebut sebagi tabung Crookes. Pengamatan Crookes tehadap karakteristik sinar katode dapat disimpulkan sebagai berikut: - Sinar katode merambat lurus.
- Sinar katode membawa muatan karena dibelokkan dalam medan magnet.
- Sinar katode memiliki massa karena dapat memutar kincir kecil dalam tabung.
- Sinar katode menyebabkan materi seperti gas dan zat lain berpijar.
- Akhirnya Crookes menyimpulkan bahwa sinar katode adalah partikel bermuatan.
Pada tahun 1891, George Johnston Stoney, berpendapat bahwa sinar katode adalah partikel, ia menamakan sebagai elektron. Pada tahun 1897, J.J. Thomson membuktikan bahwa sinar katode adalah merupakan berkas partikel, dengan menggunakan tabung sinar katode khusus. PROTON Pada tahun 1886, Eugene Goldstein, membuktikan adanya muatan positif. Pembuktian dilakukan menggunakan tabung sinar katode dimana plat katode telah diberi lubang. Ia mengamati jalannya sinar katode yang merambat menuju anode, tenyata terdapat sinar lain yang bergerak dengan arah berlawanan melewati lubang pada plat katode. Oleh karena arahnya berlawanan, maka sinar tersebut haruslah terdiri dari muatan positif. NEUTRON Penemuan partikel neutron diawali oleh penelitian Rutherford, dalam eksperimennya ia berusaha menghitung jumlah muatan positif dalam inti atom dan massa inti atom dan ia mendapati bahwa massa inti atom hanya setengah dari massa atom. Pada tahun 1920, William Draper Harkins, berasumsi bahwa terdapat partikel lain dalam inti atom selain proton, partikel itu bermassa hampir sama dengan proton dan tidak bermuatan, ia menyebutnya sebagai neutron. Hingga tahun 1932, James Chadwick, membuktikan keberadaan partikel neutron. Adanya penemuan neutron ini, membuat strukur atom semakin jelas, bahwa atom tersusun atas inti atom dengan elektron mengelilingi pada lintasan kulitnya. Inti atom terdiri dari proton yang bermuatan positif dan neutron yang tidak bermuatan. Sedangkan elektron bermuatan negatif. |
| |
| Nomor Massa Dan Nomor Atom |
| 
Contoh penulisan notasi unsur.
 
|
. Setiap elektron yang mengorbit mempunyai momentum sudut sebesar
yang merupakan bilangan bulat positif dan disebut sebagai bilangan kuantum utama.


















![clip_image014[1] clip_image014[1]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEgLijI55lfs-KXFhDGmg8VTkdc9vp_09dCqYpSSk7W2iQi2h7oMILExGI02t0KYBYUbLwaslu7AH2DC0EBaf6kMXCR-0uXaczQNRiox8q_5vRwCjq3DUlfiZt5ACBqItyRQDhS7nEtiC50/?imgmax=800)









thanks ya atas infonya
BalasHapusthank buat kerjain PR<<<>>>
BalasHapustanks..............
BalasHapusJadi, energi seperti apakah yang bisa membuat elektron bisa bergerak di kulit atom? apakah ada energi misalnya energi cahaya bisa menyebabkan pergerakan elektoron mengelilingi inti atom?
BalasHapus